科研干货:小鼠小肠类器官构建指南
小鼠小肠类器官作为一种体外模型,广泛应用于肠道疾病研究、药物筛选等领域。类器官构建细胞来源通常有原代细胞和干细胞两种,由于小鼠肠道原代细胞来源广泛、能够更好地模拟体内真实情况、培养相对简单,能够满足大多数研究和应用需求,因此,小鼠小肠类器官通常使用组织分离出的原代细胞构建。今天我们就来看看如何利用原代细胞构建小鼠小肠类器官。
材料准备
♦ 实验动物:根据实验要求选择合适的小鼠品系。
♦ 实验试剂:小鼠小肠类器官用培养基(可自行配制,也可直接购买),基质胶,DPBS,组织消化液等。
♦ 实验耗材:无菌操作所需的培养皿、离心管、移液枪头、24孔板等,以及用于细胞过滤的70μm细胞滤网。
实验步骤
♦ 小肠组织取材
1. 小鼠处死后,表面喷洒酒精杀菌。在无菌环境下截取出近胃端处3-15cm肠组织,用镊子小心去除肠道外部的肠系膜、脂肪,放入4℃预冷的含1%双抗的DPBS溶液中。
2. 使用注射器冲洗肠道2-3次,用手术剪将肠管小心剪开,肠腔面朝上,用手术刀片轻轻刮去肠腔表面肠绒毛,待肠绒毛被刮净后(呈现透明),将肠组织置于新的含DPBS的培养皿中清洗2-3次。

♦ 隐窝分离
1. 将清洗后的小肠组织剪碎至2mm宽大小,转移至新的50ml离心管中,用DPBS小心清洗3-5次,除去肠绒毛细胞和漂浮脂肪组织。
2. 在清洗好的小肠碎片组织加入10-15ml含有3-5mM EDTA的预冷DPBS中消化,4℃孵育30min左右,其间每10min轻摇一次离心管。
3. 消化完成后,弃去EDTA消化液上清,用新的DPBS缓冲液将组织轻柔漂洗2-3次以去除剩余EDTA。
4. 在小肠组织碎片中加入10-15ml预冷的含0.1%BSA的DPBS,反复吹打、重悬,使隐窝与基底层分离,然后取少许悬液镜检,当看有大量隐窝样结构后,停止吹打,并对吹打后的组织悬液使用70μm滤网过滤并收集穿过滤网的组织悬液。
5. 收集得到的组织悬液,1500rpm、4℃离心3min。
♦ 基质胶包埋与培养
1. 用基质胶重悬隐窝组织沉淀,使每10μL基质胶悬液包含200-600个隐窝,重悬后混合液置于冰上,尽快操作以避免基质胶凝固。
2. 将混合悬液种植于24孔板底部正中央,每孔30-50μL左右,不接触孔板侧壁。
3. 将种植后的培养板至于37℃二氧化碳恒温培养箱中,孵育30min左右待基质胶凝固。
4. 待基质胶完全凝固后,沿壁缓慢加入小鼠肠类器官培养基,每孔800μL/孔。
5. 将24孔板置于37℃二氧化碳培养箱中培养。每3天更换一次新鲜培养基并监测类器官生长状态(一般小鼠小肠类器官在5-7天内形成)。
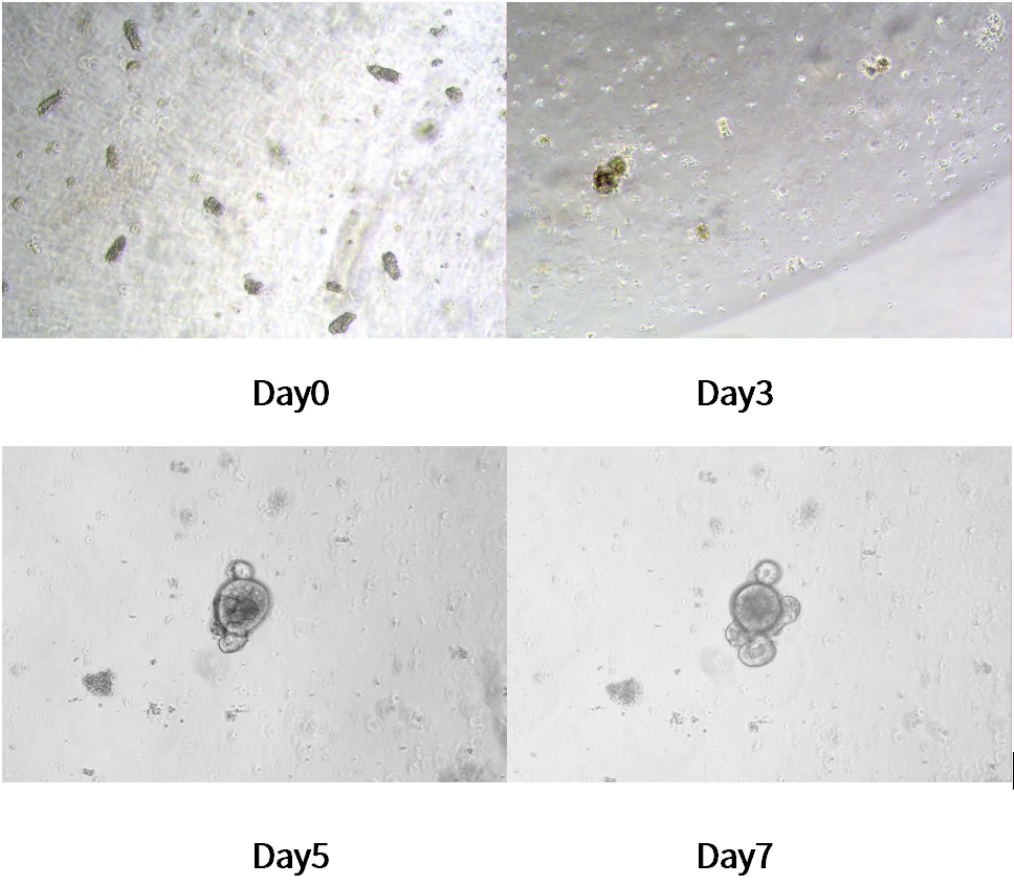
小鼠小肠类器官不同天数生长情况
注意事项
♦ 无菌操作:整个构建过程需严格遵守无菌操作原则,避免污染。
♦ 温度控制:基质胶操作需在冰上进行,避免其提前凝固;培养基在使用前需恢复至室温。
♦ 操作轻柔:在分离隐窝和处理基质胶时,动作要轻柔,避免产生气泡或破坏隐窝结构。
希望以上内容能够帮助你顺利构建小鼠小肠类器官,有问题欢迎大家留言讨论哦。
Arcegen,全球领先的综合生命科学产品供应商,产品范围包括细胞、蛋白质、抗原、抗体等在内的多种产品。其中,类器官技术平台自研产品涵盖基质胶、培养基、无血清添加剂、细胞因子等,高活性、低内毒、批间一致性高,实现自动化生产流程,致力于简化、标准化类器官培养,实现类器官培养最优解。
产品推荐
相关产品